こんにちは、シエン(@M12n08Jp)です。
IRされた論文のDeepLでの翻訳です。
論文ページ(原文:英語)→ https://www.sciencedirect.com/science/article/pii/S2372770520300784?via%3Dihub#bib6
- 要すれば、OBP301とOBP702が小児癌にも絶大な効果があったという論文なのですね!
- OBP-301およびOBP-702は、NB細胞におけるオートファジーに関連して強力な抗腫瘍効果を示しました。
- OBP-301およびOBP-702は、皮下CHP-134腫瘍の増殖を有意に抑制しました。
- OBP-301と比較して、OBP-702は検査したすべてのNB細胞株に対してより強い抗腫瘍効果を示した。
- OBP-301およびOBP-702の頻繁な投与が、MYCNで増幅されたNB腫瘍の除去に使用するための高い治療可能性を秘めていることを示唆しています。
小児がんは、小児がかかるさまざまながんの総称です。一般的には15歳未満にみられるがんのことです。
主な小児がんは、白血病、脳腫瘍、リンパ腫、神経芽腫しんけいがしゅ、胚はい細胞腫瘍・性腺腫瘍などです。血液のがんである白血病やリンパ腫を除き、大人ではまれなものばかりです。
神経芽腫、腎芽腫(ウィルムス腫瘍)、肝芽腫など「芽腫」と呼ばれるがんの原因は、胎児の体の神経や腎臓、肝臓、網膜もうまくなどになるはずだった細胞が、胎児の体ができあがった後も残っていて、異常な細胞に変化し、ふえていった結果と考えられています。大人のがんとは異なり、生活習慣にがんの発生原因があると考えられるものは少なく、網膜芽腫やウィルムス腫瘍のように、一部遺伝するものもあります。
以下、邦訳(DeepLでの翻訳)
邦訳
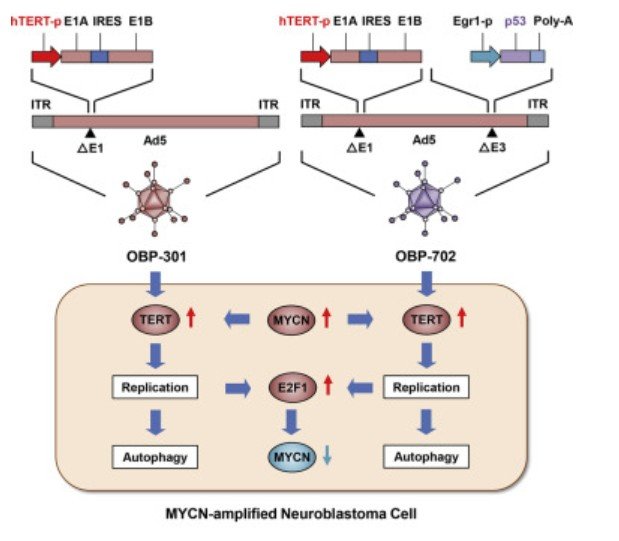
神経芽腫(NB)は末梢交感神経系の原発性悪性腫瘍である。高リスクの神経芽腫は、MYCN増幅とヒトテロメラーゼ逆転写酵素(hTERT)再配列を特徴とし、hTERT活性化に寄与し、予後不良となる。我々は、hTERT活性化腫瘍を標的とするために、hTERTプロモーターが腫瘍特異的なウイルス複製のためのウイルスE1遺伝子の発現を駆動する2つのオンコロイド性アデノウイルス、OBP-301と腫瘍抑制剤p53を搭載したOBP-702を開発した。本研究では、高いhTERT発現を示す4つのヒトMYCN増幅NB細胞株(IMR-32, CHP-134, NB-1, LA-N-5)を用いて、hTERTが駆動するオンコロイド性アデノウイルスOBP-301およびOBP-702の治療効果を実証した。その結果、OBP-301とOBP-702はNB細胞のオートファジーに関連して強い抗腫瘍効果を示した。また、ウイルスを介したE2F1タンパク質の活性化によりMYCNの発現が抑制された。OBP-301およびOBP-702は、皮下CHP-134腫瘍の増殖を有意に抑制した。このように、これらのhTERT駆動型オンコロイドアデノウイルスは、E2F1タンパク質の抑制を介したMYCN発現抑制を介して、MYCN増幅したNB細胞を排除するための有望な抗腫瘍剤であると考えられた。
序章
神経芽腫(NB)は、末梢交感神経系の悪性腫瘍である1 。NBは最も一般的な頭蓋外固形腫瘍であり、小児がんの全死亡者数の15%を占めている2 。低リスクのNB腫瘍は自然に消失または良性腫瘍に分化するのに対し、高リスクのNB腫瘍は急速に進行し、浸潤性および転移性の表現型を示す3 。MYCNは高リスクの乳腺腫瘍における進行性疾患および予後不良と強く関連しているため、4 MYCNは高リスクの乳腺腫瘍の悪性度を維持する上で中心的な役割を果たしていると考えられており、MYCNはこの疾患の治療のための魅力的な治療標的であることが示唆されています5。一方、最近の包括的なゲノム解析の結果、ヒトテロメラーゼ逆転写酵素(hTERT)再配列がハイリスクNB腫瘍の新たな予後因子であることが示唆された7,8 。興味深いことに、MYCN増幅とhTERT再配列を示すハイリスクNB腫瘍は、hTERT発現の転写活性化と類似した特徴を有している。したがって、高hTERT発現は、MYCN増幅および/またはhTERT再配列を伴う高リスクNBの治療のための新しい治療標的となる可能性がある。
9 hTERT を活性化した悪性腫瘍細胞を標的とするために、我々は 2 種類の hTERT 駆動型オンコロイドアデノウイルス、OBP-301(テロメライシン)10 と腫瘍抑制剤 p53 を発現する OBP-702,11 を開発し、hTERT プロモーターが腫瘍特異的なウイルス複製のための E1 遺伝子を駆動した。OBP-301およびOBP-702は、hTERTを発現する様々なヒト癌細胞において、オートファジーやアポトーシスに伴う溶血死を誘導する治療効果があることが示されています11, 12, 13, 14。さらに、前臨床試験では、OBP-301が放射線治療に対して腫瘍細胞を感作することが示されており16、現在、食道癌患者を対象に、放射線治療との併用によるOBP-301の第I/II相試験が進行中である。高リスクのNB腫瘍は高いhTERT発現を示すため、hTERTを標的としたオンコロイド療法は、この疾患の治療に理想的な抗腫瘍戦略である可能性がある。
本研究では、MYCN増幅NB細胞に対するhTERT駆動型オンコロイドアデノウイルスOBP-301およびOBP-702の治療効果を検討した。ウイルスによる抗腫瘍効果の分子機構を明らかにするために、ウイルス感染したNB細胞におけるアポトーシスおよびオートファジー関連マーカーとMYCNの変調を評価した。最後に、皮下NB異種移植腫瘍モデルを用いて、オンコロイド性アデノウイルスのin vivo抗腫瘍効果を評価した。
結果
MYCN増幅NB細胞におけるCARとhTERTの発現
アデノウイルス血清型 5(Ad5)は、ウイルス繊維ノブとコックスサッキーウイルスおよびアデノウイルス受容体(CAR)タンパク質との結合を介して標的細胞に侵入する。17 Ad5 ゲノムに基づいて生成された hTERT-driven oncolytic adenovirus の NB 細胞における治療の可能性を評価するために、我々はフローサイトメトリー分析を用いて、4 つのヒト MYCN 増強 NB 細胞株(IMR-32、CHP-134、NB-1、LA-N-5)における細胞表面 CAR タンパク質の発現レベルを測定しました。すべてのNB細胞株は、細胞表面にCARの発現を示した(図1A)。次に、リアルタイムRT-PCR分析を用いて、MYCN増幅NB細胞におけるhTERT mRNAの発現レベルを測定した。ヒト肺癌H1299細胞と比較して、すべてのNB細胞株は約2倍から13倍の高いhTERT mRNAの発現を示した(図1B)。対照的に、正常ヒト肺線維芽細胞WI38細胞ではhTERT mRNAの発現は検出されなかった(図1B)。さらに、MYCN増幅NB細胞株では、ウエスタンブロットによりMYCNタンパク質の発現を確認した(図1C)。観察されたCARおよびhTERTの発現は、MYCN増幅NB細胞がhTERT駆動オンコロイドアデノウイルスに敏感であることを示唆している。

図1. MYCN増幅を示すヒトNB細胞におけるCARタンパク質とヒトテロメラーゼ逆転写酵素(hTERT)mRNAの発現
A)ヒトNB細胞におけるCARタンパク質の発現をフローサイトメトリーを用いて解析した。細胞をマウス抗CARモノクローナル抗体でインキュベートした後、FITC標識二次抗体で検出した。アイソタイプにマッチした正常マウスIgGをコントロールとして使用した。(B) hTERT mRNAの発現をqRT-PCRを用いて解析した。hTERT mRNAの発現レベルは、H1299細胞におけるhTERT mRNAの発現レベルを1としたときの相対値を算出した。 データは、平均±SD(n = 3)として表した。C)ヒトNB細胞におけるMYCNタンパク質の発現をウエスタンブロッティングを用いて分析した。β-アクチンをローディングコントロールとしてアッセイした。
MYCN増幅NB細胞に対するhTERT駆動型抗がん剤アデノウイルスのin vitro細胞病理学的効果
MYCN増幅NB細胞に対するhTERT駆動オンコロイドアデノウイルスの治療可能性を調べるために、3′-[1-(フェニルアミノカルボニル)-3ナトリウムを用いて、ウイルス感染後3日目にNB細胞の生存率を評価した。 4-テトラゾリウム]-ビス(4-メトキシ-6-ニトロ)ベンゼンスルホン酸水和物(2,3-ビス-(2-メトキシ-4-ニトロ-5-スルホフェニル)2H-テトラゾリウム-5-カルボキサニリド)アッセイ。OBP-301およびOBP-702の両方とも、用量依存的にすべてのNB細胞の生存率を有意に減少させた(図2A;図S1)。IMR-32およびLA-N-5細胞の生存率は、ウイルス感染後5日目にさらに低下した(図S2)。OBP-301と比較して、OBP-702は、検査したすべてのNB細胞株に対してより強い抗腫瘍効果を示した。また、SK-N-SH 細胞は非MYCN増幅型NB 細胞として報告されており、hTERT の発現が高いことが報告されている18 。非MYCN増幅SK-N-SH細胞は高いhTERT発現を示し、OBP-301およびOBP-702に対してもMYCN増幅NB細胞と同様に感受性を示した(図S3およびS4A)。これらの結果は、hTERTを発現するNB細胞がOBP-301およびOBP-702に敏感であることを示唆している。

図2. ヒトNB細胞におけるオートファジーとの関連におけるOBP-301およびOBP-702のin vitro細胞病理学的効果
A)IMR-32およびCHP-134細胞を指示されたMOIでOBP-301またはOBP-702に感染させ、感染後3日目にXTTアッセイを用いて細胞生存率を評価した。細胞生存率は、1.0としたモック感染細胞に対する相対値を算出した。細胞生存率データは、平均値±SD(n = 5)で表した。∗p < 0.05(対 MOI 0)。(B) OBP-301またはOBP-702を72時間投与したIMR-32およびCHP-134細胞におけるウイルスE1A、p53、PARP、開裂PARP(C-PARP)および微小管関連タンパク質1軽鎖3(LC3)の発現。ヒトNB細胞におけるオートファジーとの関連でのOBP-301およびOBP-702のin vitro細胞病理学的効果
A)IMR-32およびCHP-134細胞を指示されたMOIでOBP-301またはOBP-702に感染させ、感染後3日目にXTTアッセイを用いて細胞生存率を評価した。細胞生存率は、1.0としたモック感染細胞に対する相対値を算出した。細胞生存率データは、平均値±SD(n = 5)で表した。∗p < 0.05(対 MOI 0)。(B) OBP-301またはOBP-702を72時間投与したIMR-32およびCHP-134細胞におけるウイルスE1A、p53、PARP、開裂PARP(C-PARP)、および微小管関連タンパク質1軽鎖3(LC3)の発現。
MYCN 増殖したNB細胞に対するウイルス媒介抗腫瘍効果の根底にあるメカニズムを探るために、ウイルス感染後3日目のアポトーシス関連タンパク質およびオートファジー関連タンパク質の発現をウエスタンブロット解析を用いて調べた。その結果、アポトーシス関連マーカーである切断ポリ(ADP-リボース)ポリメラーゼ(PARP)タンパク質の発現増加は、OBP-301およびOBP-702感染後には認められなかった(図2B)。一方、OBP-301およびOBP-702のいずれも、オートファジー誘導時にLC3-Iタンパク質から変換されるオートファジー関連マーカーLC3-IIタンパク質の発現増加を誘導した。しかし、NB細胞ではp62の発現は検出されなかった(データは示していない)。アデノウイルスE1Aタンパク質の発現は、OBP-301またはOBP-702のいずれかに感染した全てのNB細胞で増加したが、p53の発現はOBP-301では減少し、OBP-702では増加した。一方、非MYCN増幅NB細胞は、ウイルス感染後にアポトーシスとオートファジーを示した(図S4B)。これらの結果は、OBP-301およびOBP-702の両方の抗腫瘍効果が、MYCN増幅NB細胞におけるオートファジーの誘導と関連していることを示唆している。
hTERT駆動型抗がん剤アデノウイルスはMYCNの発現を低下させる
MYCNは、MYCN増幅NB細胞の悪性度維持に重要な役割を果たしている。そこで、OBP-301またはOBP-702を感染させたMYCN増幅NB細胞におけるMYCN mRNAおよびタンパク質の発現レベルを評価した。MYCN mRNAおよびタンパク質の両方の発現は、OBP-301およびOBP-702に感染したNB細胞において、用量依存的にダウンレギュレートされた(図3Aおよび3B)。ウイルス誘発性MYCNダウンレギュレーションの基礎となるメカニズムを探るために、ウイルスE1Aタンパク質の下流メディエーターであるE2F1の役割を調べた。E2F1の発現は、OBP-301およびOBP-702に感染したNB細胞において、用量依存的にアップレギュレートされた(図3B)。OBP-301およびOBP-702感染NB腫瘍細胞において、E2F1とMYCN mRNAおよびタンパク質の発現の間に有意な逆相関が観察された(図3C;図S5)。これらの結果は、E2F1がウイルス媒介によるMYCN発現のダウンレギュレーションに役割を果たしていることを示唆している。

図3. OBP-301およびOBP-702はE2F1のアップレギュレーションと関連してMYCNのダウンレギュレーションを誘導する
A)指示されたMOIでOBP-301またはOBP-702を感染させたIMR-32およびCHP-134細胞におけるMYCN mRNAの発現を72時間とし、モック感染細胞におけるMYCN mRNAの値を1とし、感染細胞におけるMYCN mRNAの相対的なレベルを倍数誘導としてプロットした。データは平均値±SD(n = 3)で表した。∗p<0.05(対MOIは0)。(B) OBP-301またはOBP-702を指示されたMOIで72時間感染させたIMR-32およびCHP-134細胞におけるMYCNおよびE2F1タンパク質の発現。MYCNタンパク質の発現レベルは、1.0としたモック感染細胞の発現レベルとの相対値を計算した。E2F1タンパク質の発現量は、1.0に設定した最もE2F1活性の高い細胞の発現量と相対的に計算した。C)OBP-301またはOBP-702で感染させたIMR-32およびCHP-134細胞におけるE2F1およびMYCNタンパク質の発現量の相関。
E2F1は抗がん剤アデノウイルス誘導MYCN抑制に関与している
E2F1を発現する非複製アデノウイルスAd-E2F1を用いて、MYCNとE2F1の関係を調べたところ、E2F1の異所性発現はIMR-32細胞とCHP-134細胞においてMYCNのmRNAとタンパク質の発現を低下させた(図4A-4C)。E2F1スモールインターフェリングRNA(siRNA)による前処理は、E2F1の抑制を介してAd-E2F1感染NB細胞におけるMYCNダウンレギュレーションを減衰させた(図4D)。対照的に、E1A欠失コントロールアデノウイルスdl312に感染したNB細胞では、MYCNタンパク質発現の抑制は観察されなかった(図S6)。これらの結果は、ウイルス媒介のE2F1活性化がMYCN増幅NB細胞におけるMYCN発現をダウンレギュレートすることを示唆している。

図4. E2F1の活性化はMYCNのダウンレギュレーションを誘導する
(A) Ad-E2F1 を投与した IMR-32 細胞および CHP-134 細胞における E2F1 タンパク質の 72 時間発現 (B) Ad-E2F1 を投与した IMR-32 細胞および CHP-134 細胞における MYCN mRNA の 72 時間発現 (MOI) を示した。データは、平均±SD(n = 3; *p < 0.05 [対 MOI 0])として表される。(D) コントロール siRNA または E2F1 siRNA (100 nM)で前処理した IMR-32 細胞および CHP-134 細胞における MYCN および E2F1 タンパク質の発現 (100 MOI)。
OBP-702を介したp53活性化はウイルス感染後期に減衰する
我々は、OBP-702 が p53 活性化を介して様々なタイプの腫瘍細胞において OBP-301 よりも深い抗腫瘍効果を誘導することを実証した11,14。OBP-301 または OBP-702 感染後 0、24、48、72 時間後の IMR-32 および CHP-134 細胞からタンパク質ライセートを調製した。アデノウイルス E1A の発現は 24-48 h で増加し、下流メディエーター E2F1 の発現は OBP-301 または OBP-702 感染後 48-72 h で増加した(図 5)。OBP-301 に感染した NB 細胞では、48 時間後に MYCN 発現が減少し、E2F1 のアップレギュレーションと一致した。一方、OBP-702感染NB細胞では、p53の発現は低下したものの、24時間後にはMYCNの発現が低下し、E2F1の発現は低下したものの、48~72時間後にはMYCNの抑制が増強された。これらの結果は、OBP-702を介したMYCNダウンレギュレーションには、p53ではなくE2F1が主に関与していることを示唆している。

図5. OBP-702を介したp53の活性化はMYCNのダウンレギュレーションには関与していない
IMR-32 および CHP-134 細胞を MOI 100 で OBP-301 または OBP-702 に感染させ、指示された時点で細胞を採取した。細胞溶解物中のE1A、p53、PARP、C-PARP、LC3-I、LC3-II、E2F1、およびMYCNタンパク質のレベルをウエスタンブロット法で分析した。β-アクチンをローディングコントロールとしてアッセイした。
皮下CHP-134ゼノグラフト腫瘍モデルにおけるhTERT-Driven Oncolytic Adenovirusのインビボでの抗腫瘍効果
最後に、hTERT駆動オンコリー化アデノウイルスのin vivo抗腫瘍効果を評価するために、皮下CHP-134キセノグラフト腫瘍モデルを使用した。ウイルス処理の異なるプロトコルを用いて2つのin vivo実験を行った。OBP-301、OBP-702、またはPBSを、週に1回、または週に3回、3サイクルの間、皮内に注入した。ウイルスの3回の投与では腫瘍増殖を抑制するのに十分ではなかったが(図S7)、CHP-134腫瘍異種移植モデルにおいて、OBP-301またはOBP-702の9回の投与は、PBSと比較して腫瘍増殖を有意に抑制した(図6Aおよび6B)。しかし、腫瘍体積には、OBP-301とOBP-702治療の間に統計的に有意な差は認められなかった。免疫組織化学的分析は、OBP-301およびOBP-702処置した腫瘍の両方においてMYCN発現の減少レベルを明らかにした(図6C)。さらに、コントロール腫瘍と比較して、ウイルス処理した腫瘍では、Ki67陽性増殖細胞の割合が有意に減少していた(図6D)。対照的に、CHP-134腫瘍では、p53発現は検出されなかった(図S8)。これらの結果は、OBP-301およびOBP-702の頻繁な投与が、MYCN増幅NB腫瘍の除去における使用のための高い治療上の可能性を有することを示唆している。
図 6. OBP-301およびOBP-702の皮下CHP-134ゼノグラフト腫瘍モデルにおける腫瘍成長抑制効果
6週齢の雌BALB/c nu/nuマウスの脇腹にCHP-134細胞(1×107細胞)を接種した。OBP-301(108 PFU)、OBP-702(108 PFU)、またはPBS(モック)を、週に3回、3サイクルの間、皮内注射した。A)腫瘍の成長は、平均腫瘍体積±SDとして表される(各群のn = 10または11;*p<0.05)。B)各群の全単離腫瘍の巨視的外観。C)CHP-134腫瘍の組織学的分析。腫瘍の接種から7週間後に腫瘍組織を得た。CHP-134腫瘍のパラフィン包埋切片を、ヘマトキシリンおよびエオシン(H&E)溶液、抗MYCN抗体、または抗Ki67抗体で染色した。左、中、および右の画像は、それぞれ、H&E、MYCN、およびKi67染色を示す。各図の左側の画像は低倍率、右側の画像は黒い四角で縁取られた部分を高倍率で示しています。左側のスケールバー、200μm。右側は100μm。D)腫瘍組織中のKi67陽性細胞の割合をImageJソフトウェアを用いて算出した。データは平均値±SD(各群n=5;*p<0.05)で表しています。
議論
最近のゲノム解析により、高リスクのNB腫瘍はMYCN増幅やhTERT再配列を特徴とすることが明らかになってきた。本研究では、オートファジー誘導を介して高いhTERT発現を示すMYCN増幅型NB細胞に対して、hTERT駆動型オンコロイドアデノウイルスOBP-301およびOBP-702が抗腫瘍効果を有することを確認した。この抗腫瘍効果は、ウイルスが誘導するE2F1の活性化を伴うMYCNのダウンレギュレーションと関連していることがわかった。したがって、hTERTを標的としたオンコロイド性ウイルス療法は、MYCNの抑制を介してMYCN増幅NB腫瘍細胞を除去するための有望な抗腫瘍戦略であるように思われる。
すべてのMYCN増幅NB細胞は高いhTERT発現を示した。NB-1細胞はhTERT mRNAの発現が最も高かったが、MYCNタンパク質の発現が最も低かった。最近の報告では、MYCN増幅NB-1細胞のうち、NB-1細胞のみがhTERTプロモーター変異を有していることが示されている19,20。hTERT プロモーターの変異は、hTERT 発現が高い特定のタイプの癌に多く見られることから、21 hTERT プロモーター変異を有するヒト癌細胞には、hTERT 駆動型オンコロイドアデノウイルスが有効である可能性がある。
オートファジーは、細胞内小器官をリソソーム分解して栄養分を生成する異化過程である。腫瘍生物学では、オートファジーは細胞保護作用と細胞毒性作用の両方に関連した二重の役割を果たしている。Belounisら22は、化学療法がNB細胞の生存に関連したオートファジーを誘導し、アポトーシス抑制と化学抵抗性に寄与することを報告している。一方、オンコロイド性アデノウイルスは、過剰なオートファジー誘導を介して腫瘍細胞の細胞死に関連したオートファジーを誘導することが示されている23 。さらに、mTOR 阻害剤であるラパマイシンは、オートファジーを介して脳腫瘍細胞に対する抗腫瘍効果を向上させた。hTERT駆動のオンコロイド性アデノウイルスとオートファジー誘導性mTOR阻害剤を組み合わせることで、MYCNを増幅したNB細胞の死を誘導するためのより効果的な戦略となりうる。
MYCNは、生存、増殖、転移、血管新生の活性化を介してNB腫瘍の悪性度を維持する上で重要な役割を果たしている4。本研究では、hTERT駆動型オンコロイドアデノウイルスOBP-301およびOBP-702がMYCN発現を効率的に抑制し、抗腫瘍効果を示した。また、Liら26は、MYCNを標的としたショートヘアピンRNAを持つオンコロイド性アデノウイルスがMYCN発現を低下させることで、MYCN増幅NB細胞に対して抗腫瘍効果を発揮することを示した。また、ウイルスによる MYCN 抑制のメカニズムについては、OBP-301 および OBP-702 感染した NB 細胞において、E2F1 のアップレギュレーションが MYCN 発現を mRNA レベルおよびタンパク質レベルで抑制することを明らかにした。いくつかの報告では、MYCNとE2F1の間に関係がある可能性があることが示されている。Verenaら.27は、E2Fファミリータンパク質がMYCN遺伝子のプロモーター領域に結合することにより、NB細胞の転写レベルでMYCNの発現を抑制することを実証した。一方、StriederとLutz28は、E2F1に誘導されたmicroRNA-202がNB細胞のMYCN発現を転写後レベルで抑制することを報告している。オンコロイド療法中のE2F1媒介MYCNダウンレギュレーションの基礎となるメカニズムはまだ不明であるが、我々のデータは、hTERT駆動のオンコロイドアデノウイルスが、E2F1媒介MYCNダウンレギュレーションを介してMYCN増幅NB細胞を排除するための有望な抗腫瘍試薬であることを示唆している。
OBP-702が介在するp53活性化は、初期段階(感染後24時間)でMYCN発現をダウンレギュレートした。一方、OBP-702を介したp53活性化は、感染後48時間および72時間の後期に減衰した。さらに、OBP-301とOBP-702の抗腫瘍効果は、我々の皮下異種移植モデルにおいても同様であり、MYCN増幅NB細胞はp53活性化に対して比較的鈍感であることが示唆された。p53突然変異はNB腫瘍ではまれであり、診断時の症例の2%未満であるが、29,30 p53は直接的および間接的なメカニズムの両方を介してMYCN増幅NB腫瘍ではしばしば機能的に不活性化される。直接的な不活性化のメカニズムとしては、MYCNがp53のC末端領域に結合することで、p53の下流にある標的遺伝子が不活性化される31 。一方、間接的なメカニズムとしては、MYCNを介したMDM2活性化は、ユビキチン-プロテアソーム経路を介してMYCN増幅NB細胞におけるp53の発現を抑制する32,33。したがって、MYCN増幅NB細胞は、E2F1を介したMYCN抑制に比べて、p53を介したMYCN抑制に対して感受性が低い可能性がある。
最近、小児がんを含む様々なハイリスク小児がんの治療のために、遺伝子改変に基づく個別化医療のアプローチが登場しています34 。本研究では、テロメラーゼを標的としたオンコロイド性アデノウイルスのMYCN活性化NB細胞に対するin vitroおよびin vivoでの治療効果を確認しました。MYCNの抑制は、ウイルスが媒介する抗腫瘍効果の根底にあるメカニズムにおいて重要な因子である。最近の包括的なゲノム解析により、MYCN増幅36またはhTERT再配列を示す高リスクのNB患者ではhTERTが一般的に活性化されていることが明らかになった7,8。したがって、我々が開発した新規のhTERT駆動型オンコロイドウイルス療法は、MYCN増幅またはhTERT再配列を示す高リスクのNB細胞を排除するための特に有用な抗腫瘍戦略となりうる。
NB腫瘍は、最も頻繁に副腎および体内の後腹膜病変から発生する。原発性NB腫瘍を超音波画像診断またはオンコロイド性アデノウイルスの術中注射により標的とすることができる。手術で切除不能な残存腫瘍にこれらのウイルスを注入することは、原発性NB腫瘍の局所制御に有効な選択肢かもしれない。しかし、MYCNを増幅したNB細胞は、遠隔臓器に転移性腫瘍を発生することが多く、オンコロイド性アデノウイルスの腫瘍内注射は不可能である。したがって、アクセスできない転移性NB腫瘍を標的とした治療戦略を開発する必要がある。最近の証拠は、オンコロイド性ウイルス療法が免疫原性細胞死の誘導を介して抗腫瘍免疫応答を誘導することを示唆している37, 38, 39 オンコロイド性アデノウイルスは、ダメージに関連した分子パターンの放出を介して免疫原性細胞死を誘導することが示されている40。我々は最近、hTERT駆動オンコリー性アデノウイルスを原発部位に皮内注射することで、肝臓の転移性大腸直腸腫瘍における免疫チェックポイント阻害剤の治療効果が高まることを明らかにした41。
結論として、テロメラーゼを標的としたオンコロイド性アデノウイルスOBP-301およびOBP-702の使用は、MYCNの抑制を介したMYCN増幅性NB腫瘍の治療に有望な治療法であることを示した。テロメラーゼを標的としたオンコロイドウイルス療法の安全性と実行可能性を調べるために、MYCNとhTERTの過剰発現を示す高リスクのNB患者を対象とした更なる臨床研究が必要である。
材料と方法
セルライン
(とりあえずここまで)by シエン
4588オンコリスバイオファーマの将来性/がんを切らずに治す ウイルス療法テロメライシン
4588オンコリスバイオファーマ/2013年上場時の浦田社長インタビュー